Exosomas como sistemas de delivery de drogas
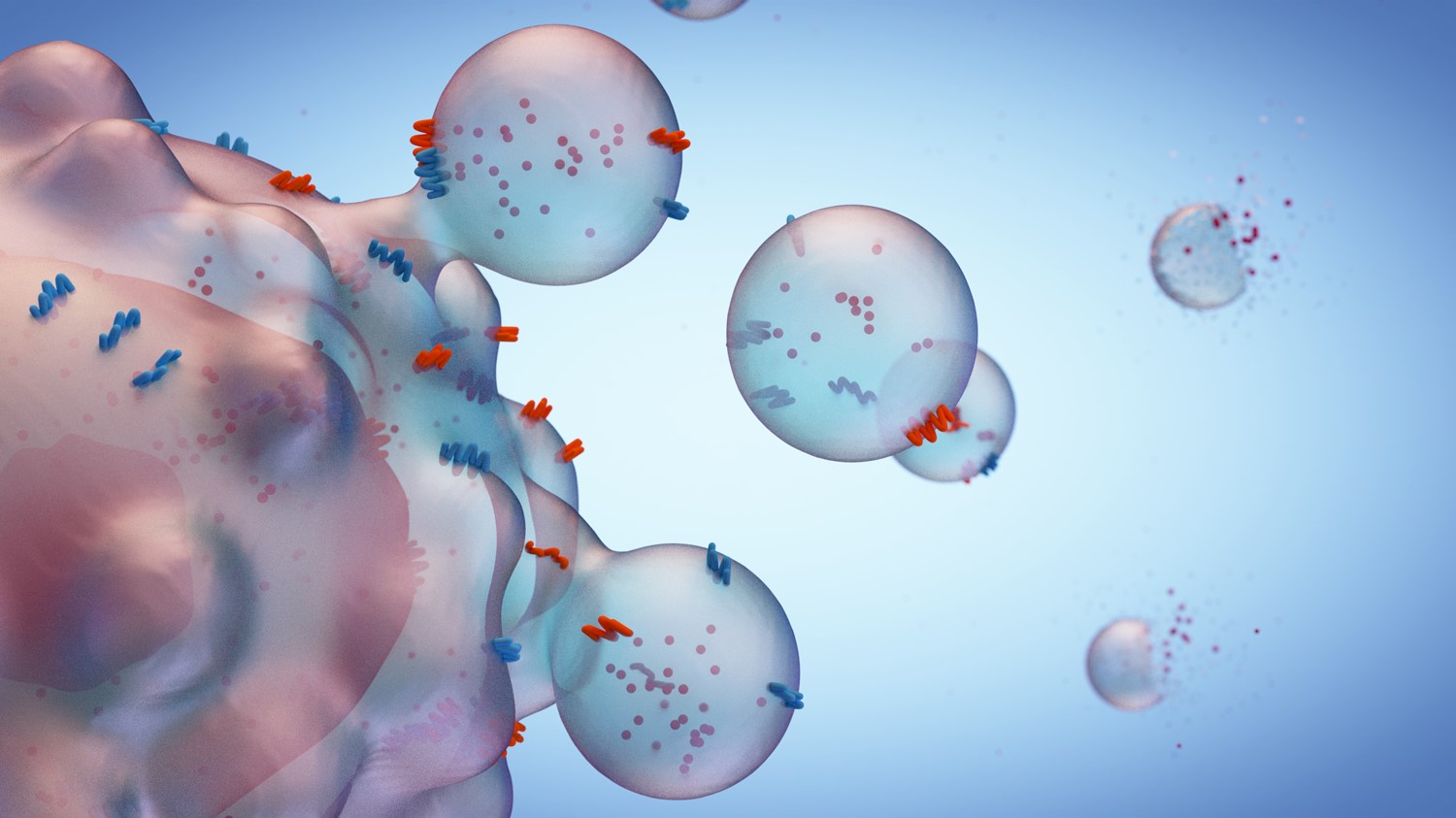
Las células eucariotas y procariotas pueden liberar al entorno extracelular una variedad de nano y micro vesículas que contienen membranas llamadas colectivamente, vesículas extracelulares (VE); las cuales pueden ser cultivadas de los sobrenadantes de cultivos celulares y de fluidos del cuerpo incluido plasma, saliva, orina, leche y fluido cerebroespinal (1). De acuerdo a su origen y tamaño pueden dividirse en tres grupos a) exosoma (diámetro en rango de 30-150 nm), b) microvescículas o ectosomas (50nm- 1 μm) y cuerpos apoptóticos (50 nm–5 μm) (2).
El exosoma desempeña un papel en la comunicación intercelular al transportar biomoléculas como proteínas, lípidos, carbohidratos y ácidos nucléicos entre las células vecinas o incluso a órganos distantes. Esta variedad de carga depende del origen de las VE, el estado fisiológico y patológico; dado que puede ser marcador de diversas patologías como cáncer, enfermedades inflamatorias, enfermedades neurodegenerativas como priones, Alzheimer, enfermedad de Huntington, por lo que son investigados con el propósito de buscar nuevos marcadores para estas enfermedades (2).
La biogénesis de los exosomas comienza en el sistema endosomal. El proceso comienza desde los endosomas tempranos que maduran hasta convertirse en endosomas tardíos o cuerpos multivesiculares, que la membrana endosomal invagina para producir vesículas intraluminales o exosomas en el lumen de los organelos. Los cuerpos multivesciculares (MVB) se fusionan con la membrana plasmática de la célula y liberan los exosomas en el entorno extracelular de una manera exocítica (1).
Fig 1: Biogénesis del exosoma
Aislamiento de los exosomas:
Los exosomas pueden ser aislados por centrifugación diferencial, filtración, cromatografía de exclusión por tamaño y por inmunoafinidad.
- La centrifugación diferencial: Es el método más utilizado para el aislamiento de exosomas, el cual consta de varios pasos, incluyendo (1) una centrifugación de baja velocidad para eliminar células apóptoticas (2), un giro de mayor velocidad para eliminar vesículas más grandes y finalmente (3), centrifugación de alta velocidad para precipitar exosomas, motivo por el cual, la eficiencia del método es menor.
- Filtración: Los exosomas se pueden separar de soluciones de proteínas y agregados utilizando matrices con límites de exclusión de peso molecular definidos, pudiendo ser aislado selectivamente en base a un peso molecular.
- Cromatografía de exclusión de tamaño: También conocida como cromatografía de tamiz molecular, es un método en el que la separación de diferentes compuestos se realiza de acuerdo con su tamaño (volumen hidrodinámico) medido por la eficiencia con la que penetran en los poros de la fase estacionaria. La cromatografía de exclusión de tamaño tiene dos versiones básicas. En comparación con el método de ultracentrifugación, con EV altamente variable en los rendimientos (2–80%), este método es superior con un 43% de recuperación estable de EV, con eliminación casi completa de proteínas contaminantes. Las desventajas de este método son (1) La accesibilidad de la columna cromatográfica a contaminación por lo tanto, se deben garantizar condiciones de trabajo asépticas, especialmente si las EV aisladas están destinadas para uso terapéutico y (2) un gran número de fracciones deben ser recopiladas y analizadas para garantizar una separación completa de los subtipos EV y proteínas contaminantes.
- Captura por inmunoafinidad: Método que usa lectinas o anticuerpos contra marcadores exosomales como CD63, CD81, EpCAM y Rab5.
Exosomas como sistema de administración terapéutica:
Un sistema de administración terapéutica basado en exosomas tiene beneficios particulares, como la especificidad, la seguridad y la estabilidad. Por su característica de orientación, los exosomas pueden entregar su carga a objetivos específicos a larga distancia. Los exosomas también pueden ser utilizados para administrar ARN interferente (siARN) o sustancias farmacológicamente activas. Como los exosomas son pequeños y provenientes de los animales, son capaces de evitar el fagocitosis, fusionarse con la membrana celular, y pasar por alto el engullido de los lisosomas. El exosoma también puede exhibir una mayor estabilidad en la sangre que les permite viajar largas distancias dentro del Cuerpo tanto en condiciones fisiológicas como patológicas, además, los exosomas tienen un núcleo hidrófilo, lo que los hace adecuados para albergar fármacos solubles en agua.
Los métodos para la carga de exosomas pueden ser clasificados en dos estrategias diferentes, 1) carga después de aislamiento y (2) carga durante la formación. Para la carga de carga después del aislamiento, uno de los métodos es la electroporación. Al aplicar un campo eléctrico a una suspensión de exosomas (o células) y la carga terapéutica de elección, se crean poros en la bicapa lipídica, facilitando así el movimiento de carga hacia el lumen de los exosomas. La incubación simple de exosomas con la carga también se usó como uno de los métodos para cargar exosomas. Otro método para aplicar carga en exosomas es la sonicación. Donde una mezcla de fármaco-exosoma es sometido a sonicación durante seis ciclos de 30 segundos de encendido/apagado durante un total de 3 minutos con un período de enfriamiento de 2 minutos, lo que resulta en una carga efectiva del medicamento en el exosoma.
Exosomas como delivery en el cáncer de pulmón:
El cáncer de pulmón es uno de los cánceres más mortales y es una de las principales causas de mortalidad por cáncer en todo el mundo. Los carcinomas de pulmón se dividen en dos clases; carcinoma de pulmón de células pequeñas (SCLC) y carcinoma de pulmón de células no pequeñas (NSCLC), donde el NSCLC representa la mayoría de los casos (> 85%).
NSCLC está subclasificado como adenocarcinoma (50%), carcinoma de células escamosas (~ 40%) y carcinoma de células grandes (~ 10%). El cáncer de pulmón en el NSCLC es difícil de tratar de manera efectiva, ya que su patología aún no está clara. Las investigaciones recientes se han centrado en intentar superar el NSCLC mediante el uso de tecnología nanotransportadora. En la investigación, realizada por Kim MS, al trabajar con exosomas tempranos derivados de macrófagos, cargados con el agente anticancerígeno Paclitaxel (PTX) representa una novel nano formulación que mostró alta eficiencia anticancerígena en ratones con metastasis de cancer pulmonar, modificando los exosomas con aminoethylanisamide-polyethylene glycol (AA-PEG) para mejorar su tiempo de circulación en la sangre y permitir la detección de metástasis pulmonares.
Al utilizar este exosoma modificado, el medicamento puede administrarse selectivamente a las células cancerosas objetivo y también puede aumentar la tasa de supervivencia del paciente con cáncer de pulmón. (3)
Fig 2: Representación esquemática de la variación de exosomas
derivados de macrófagos como delivery para el tratamiento del cáncer de pulmón
Bibliografía:
1. Bunggulawa E J, et at. 2018. Recent advancements in the use of exosomes as drug delivery systems. J Nanobiotechnology, 2018
2. Taylor, J., S., et al. 2013. Editorial, 8 April 2013. Exosomes and Microvesicles. https://doi.org/10.5772/56520
3. Kim MS, et al.2018. Engineering macrophage-derived exosomes for targeted paclitaxel delivery to pulmonary metastases: in vitro and in vivo evaluations
CONOCE MÁS SOBRE BIOINGENIERIA EN UTEC ![]() Y VIVE LA INGENIERIA
Y VIVE LA INGENIERIA ![]() Bioingenieria
Bioingenieria ![]()