¿Cómo los "Lab on a chip” revolucionan la lucha contra el cáncer?
¿Cómo podemos estudiar un evento que ocurre a escala microscópica dentro del organismo? La respuesta está en los sistemas microfluídicos, una tecnología creciente también conocida como "laboratorios en un chip".

La mortalidad del cáncer reside, en gran medida, en su capacidad para diseminarse. Este proceso, conocido como metástasis, implica que células malignas se desprenden del tumor original para invadir otras partes del cuerpo y formar nuevos focos de enfermedad. Comprender y detener este fenómeno es uno de los mayores desafíos de la oncología. ¿Cómo podemos estudiar un evento que ocurre a escala microscópica dentro del organismo? La respuesta está en los sistemas microfluídicos, una tecnología creciente también conocida como "laboratorios en un chip".
La orientación química del proceso metastásico
Las células cancerosas no se mueven al azar. Su migración es un proceso dirigido por señales químicas, un mecanismo denominado quimiotaxis. Las responsables de dirigir esta migración son principalmente unas proteínas llamadas quimiocinas (como CXCL12 y CCL21) que, al unirse a sus receptores específicos en la célula tumoral, las atraen hacia destinos preferentes como los ganglios linfáticos, los pulmones o el hígado.
Las investigaciones han revelado que la inflamación es un factor crítico que intensifica este proceso. Las moléculas proinflamatorias como la interleucina-6 (IL-6), generalmente presentes en el microambiente tumoral, pueden provocar que las células de cáncer de mama aumenten la cantidad de receptores de quimiocinas en su superficie. Esto las vuelve mucho más sensibles a las señales de migración, potenciando su capacidad de moverse e invadir nuevos tejidos.
De los métodos convencionales a la microfluídica
Tradicionalmente, la migración celular se estudiaba con herramientas como la cámara de Transwell. Si bien es útil, presenta limitaciones importantes, como la imposibilidad de observar el movimiento celular en tiempo real y la falta de un control preciso sobre los gradientes químicos que guían a las células.
Los dispositivos microfluídicos superan estas barreras. Son plataformas miniaturizadas que permiten recrear entornos biológicos de manera controlada. Sus ventajas son transformadoras para la investigación:
Control preciso de gradientes: Permiten generar y mantener gradientes de quimiocinas estables y medibles, imitando fielmente las condiciones del cuerpo humano.
Observación directa en tiempo real: Facilitan la visualización con microscopía de alta resolución del comportamiento celular mientras ocurre, analizando cómo las células se mueven y se adaptan al entorno.
Recreación de microambientes tridimensionales (3D): Hacen posible construir modelos que incluyen la matriz extracelular (el "andamiaje" de los tejidos) e incluso integrar estructuras vasculares o linfáticas, ofreciendo un escenario mucho más realista.
Eficiencia de recursos: Operan con volúmenes mínimos de muestras y reactivos, lo cual es crucial cuando se trabaja con células de pacientes o compuestos costosos.
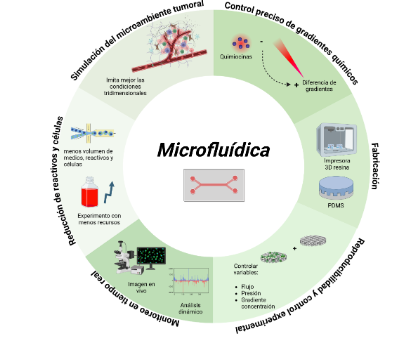
Ilustración 1 Ventajas de los dispositivos microfluídicos
Avances significativos de las plataformas microfluídicas
El uso de esta tecnología ya ha arrojado luz sobre mecanismos antes inaccesibles:
La complejidad de la quimiotaxis: Se ha descubierto que la quimiocina CXCL12 existe en diferentes versiones o "isoformas". Notablemente, la isoforma gamma podría ser un biomarcador de cáncer de mama metastásico avanzado. Este hallazgo es importante, ya que el fármaco AMD3100, diseñado para bloquear el receptor de CXCL12, no inhibe completamente esta isoforma, lo que demuestra la necesidad de desarrollar terapias más específicas.
El microambiente tumoral: Se ha confirmado que el entorno del tumor no es un espectador pasivo. Los dispositivos microfluídicos han demostrado que las células endoteliales (que recubren los vasos sanguíneos) pueden depositar fibronectina, una proteína que las células cancerosas utilizan para aumentar su capacidad de invasión. Además, ciertas células inmunes, como los macrófagos, pueden ser inducidas a secretar TNF-alfa, una molécula que aumenta la permeabilidad de los vasos sanguíneos y facilita la entrada de las células tumorales a la circulación (intravasación).
La preparación del "nicho premetastásico": Estos estudios ayudan a entender cómo un tumor primario puede preparar un órgano distante para la metástasis. El tumor libera factores que viajan por el cuerpo y modifican el entorno de un futuro sitio metastásico, creando un "nicho" favorable para que las células cancerosas que lleguen después puedan anidar y crecer.
Perspectivas futuras e impacto clínico
La comprensión detallada que nos brindan los laboratorios en un chip tiene un impacto directo en la lucha contra el cáncer. Nos permite:
Identificar nuevos objetivos terapéuticos: Al descubrir los mecanismos moleculares exactos de la invasión (como las isoformas de quimiocinas o el papel del TNF-alfa), se abren nuevas puertas para diseñar fármacos que los bloqueen.
Desarrollar terapias dirigidas: El objetivo es crear tratamientos que interfieran específicamente con la metástasis, ya sea impidiendo la quimiotaxis o alterando la formación del nicho premetastásico.
Impulsar la biopsia líquida: La microfluídica es una tecnología fundamental en el desarrollo de sistemas para aislar y analizar células tumorales circulantes (CTC) a partir de una simple muestra de sangre. Esto promete revolucionar el diagnóstico temprano y el seguimiento de la respuesta al tratamiento.
Referencias
Blaha, L., Zhang, C., Cabodi, M., & Wong, J. Y. (2017). A Microfluidic Platform for Modeling Metastatic Cancer Cell Matrix Invasion. IOPscience.
Cavnar, S. P., Ray, P., Moudgil, P., Chang, S. L., Luker, K. E., Linderman, J. J., Takayama, S., & Luker, G. D. (2014). Microfluidic source-sink model reveals effects of biophysically distinct CXCL12 isoforms in breast cancer chemotaxis. Integrative Biology, 6(5), 564.
Chaffer, C. L., & Weinberg, R. A. (2011). A Perspective on Cancer Cell Metastasis. Science, 331(6024), 1559–1564.
Cho, H.-Y., Choi, J.-H., Kim, K.-J., Shin, M., & Choi, J.-W. (2021). Microfluidic System to Analyze the Effects of Interleukin 6 on Lymphatic Breast Cancer Metastasis. Frontiers in Bioengineering and Biotechnology, 8, 611802.
Franco-Barraza, J., Valdivia-Silva, J. E., Zamudio-Meza, H., Castillo, A., García-Zepeda, E. A., Benítez-Bribiesca, L., & Meza, I. (2010). Actin Cytoskeleton Participation in the Onset of IL-1β Induction of an Invasive Mesenchymal-like Phenotype in Epithelial MCF-7 Cells. Archives of Medical Research, 41(3), 170–181.
Grigolato, F., Egholm, C., Impellizzieri, D., Arosio, P., & Boyman, O. (2020). Establishment of a scalable microfluidic assay for characterization of population-based neutrophil chemotaxis. Allergy, 75(6), 1382–1393.
Kramer, N., Walzl, A., Unger, C., Rosner, M., Krupitza, G., Hengstschläger, M., & Dolznig, H. (2013). In vitro cell migration and invasion assays. Mutation Research - Reviews in Mutation Research, 752(1), 10–24.
Müller, A., Homey, B., Soto, H., Ge, N., Catron, D., Buchanan, M. E., McClanahan, T., Murphy, E., Yuan, W., Wagner, S. N., Barrera, J. L., Mohar, A., VeraÂstegui, E., & Zlotnik, A. (2001). Involvement of chemokine receptors in breast cancer metastasis. Nature, 410(6824), 50–56.
Samandari, M., Rafiee, L., Hassanpour-Tamrin, S., Mirzajani, F., & Sanati-Nezhad, A. (2021). A simple and robust standalone microfluidic platform for studying cancer cell chemotaxis and invasion. Scientific Reports, 11(1), 1–16.
Valdivia-Silva, J. E., Franco-Barraza, J., Esparza Silva, A. L., Du Pont, G., Soldevila, G., Meza, I., & García-Zepeda, E. A. (2009). Effect of pro-inflammatory cytokine stimulation on human breast cancer: Implications of chemokine receptor expression in cancer metastasis. Cancer Letters, 283(2), 176–185.
Walker, G. M., Sai, J., Richmond, A., Stremler, M., Chung, C. Y., & Wikswo, J. P. (2005). Effects of flow and diffusion on chemotaxis studies in a microfabricated gradient generator. Lab on a Chip, 5(6), 611–618.
Wang, Y., Jia, J., Wang, F., Yan, Y., Zhang, Q., Fan, Y., Yuan, W., Gu, X., Hu, J., & Yang, S. (2024). Pre-metastatic niche: shaping the ‘soil’ for tumor metastasis and a novel target for anti-metastasis therapy. Signal Transduction and Targeted Therapy, 9(1), 1937.
Wu, J., Kumar-Kanojia, A., Hombach-Klonisch, S., Klonisch, T., & Lin, F. (2018). A radial microfluidic platform for higher throughput chemotaxis studies with individual gradient control. Lab on a Chip, 18(24), 3855–3865.
Zervantonakis, I. K., Jayne, S. K. H.-A., Foran, F. B., Chung, S., Charest, J. L., & Kamm, R. D. (2012). Three-dimensional microfluidic model for tumor cell intravasation and endothelial barrier function. Proceedings of the National Academy of Sciences, 109(34), 13515–13520